Wissen
Kollagen & Glycin
Disclaimer: Die Inhalte in diesem Artikel dienen zu Informationszwecken und ersetzen keinen ärztlichen Rat.
Zuletzt aktualisiert: 26. April 2023

1. Allgemeines zu Glycin
Glycin ist die strukturell einfachste Aminosäure und macht etwa 11,5 % aller Aminosäuren im menschlichen Körper aus.1 Glycin wurde erstmals vom französischen Chemiker Henri Braconnot in 1820 isoliert und bekam ihren Namen aufgrund ihres süßlichen Geschmacks in Ableitung des griechischen Wortes „glykýs“ (süß).1 Wie nachfolgend noch im Detail beschrieben wird, erfüllt Glycin vielfältige Aufgaben im Organismus, aber ist den meisten Personen vor allem aufgrund seiner bedeutenden Rolle als Hauptbestandteil von Kollagen ein Begriff.
2. Allgemeines zu Kollagen
Kollagen bezeichnet eine Gruppe an Strukturproteinen, die hauptsächlich in Sehnen, Bändern, Knochen, Knorpeln sowie in der Haut von Menschen und (Meeres-)tieren vorkommen. Eine ausreichende Zufuhr von Kollagen ist in Studien mit mannigfaltigen gesundheitlichen Aspekten assoziiert. Vor allem die positive Wirkung auf die Haut (u.a. erhöhte Elastizität, verbesserte Wundheilung, geringere Faltenbildung etc.) ist gut erforscht und gesichert.2,3,4 Darüber hinaus zeigt die Kollagengabe in Studien eine Wirksamkeit auf die Knochengesundheit und verringert dadurch u.a. das Risiko für die Entstehung von Osteoporose.5 Die Studien zur Hautgesundheit und Kollagensynthese bei veganer Ernährung sind begrenzt, jedoch zeigen die bisherigen Daten eine durchschnittlich schlechtere Hautgesundheit und verminderte Wundheilung bei veganen Probanden im Vergleich zu omnivoren.6,7 Studien zur Kollagensynthese bei vegetarischer Ernährung im Vergleich zu mischköstlicher Ernährung zeigen eine verminderte Kollagensynthese bei Vegetariern.8 Da die Zufuhr an kollagenbildenden Aminosäuren bei veganer Kost ebenso wie bei vegetarischer Kost im Vergleich zur Mischkost deutlich verringert ist,9 ist davon auszugehen, dass derartige Studienergebnisse auch auf vegane Probanden zutreffen. Da sich eine unzureichende Kollagensynthese negativ auf die Knochengesundheit auswirkt10 und eine vegane Ernährung abträglich auf die Kollagensynthese wirken kann,8 ist es auch nicht überraschend, dass eine Reihe an Studien zur Knochengesundheit bzw. dem Frakturrisiko bei veganer Ernährung ein erhöhtes Risiko zeigt.11,12,13,14
Aufgrund von Daten wie diesen ist es dringend angeraten, die Nährstoffversorgung bei veganer Ernährung zu optimieren, um damit u.a. die Haut- und Knochengesundheit zu verbessern. Beides ist von einer Vielzahl an Nährstoffen abhängig und daher ist stets auf eine insgesamt bedarfsdeckende Ernährung zu achten. Da Kollagen das häufigste Protein im menschlichen Körper ist15 und ihm wie dargelegt eine bedeutende Rolle in der Gesunderhaltung diverser Körperstrukturen zugeschrieben wird, es aber nur in tierischen Lebensmitteln vorkommt, lohnt sich eine genaue Betrachtung des Themas der Kollagensynthese bei veganer Ernährung, um nachzuvollziehen, wie die Kollagenbildung auch ohne den Verzehr tierischer Lebensmittel bestmöglich optimiert werden kann. Um die Bildung körpereigener Kollagenproteine zu optimieren, ist es unausweichlich mit der Nahrung genügend Bausteine für die Proteinsynthese zuzuführen. Die Bausteine von Kollagen werden in Abbildung 1 illustriert. Diese verdeutlicht, dass Glycin die mit Abstand häufigste Aminosäure innerhalb des Kollagenproteins ist.
Abb. 1: Aminosäurenzusammensetzung von Kollagen16,17,18

Je nach Art des Kollagens ist durchschnittlich etwa jede dritte Aminosäure im Kollagenprotein Glycin (ca. 25 % der Masse).19 100 g Kollagen enthalten – aufgrund des unterschiedlichen Gewichts verschiedener Aminosäuren – durchschnittlich etwa 25 g Glycin; der genaue Anteil kann jedoch in Abhängigkeit der Art und Herkunft des Kollagens schwanken.
3. Die Rolle von Glycin in der Kollagensynthese
Glycin ist nicht nur die am häufigsten vorkommende Aminosäure im Kollagenprotein, sondern ebenso der begrenzende Faktor in der Kollagensynthese.20 Glycin ist außerdem in der gängigen Kost der begrenzende Faktor in der Synthese von Glutathion (= schwefelhaltiges Tripeptid aus Glycin, Glutaminsäure und Cystein mit bedeutender antioxidativer Wirkung)21 und Kreatin (= Aminosäurederivat aus Glycin, Arginin und Methionin mit positiver Wirkung auf die Muskelkraft und die kognitiven Fähigkeiten).22 Glycin spielt außerdem eine wichtige Rolle in der Immunfunktion (ein Mangel schwächt das Immunsystem), als Neurotransmitter im zentralen Nervensystem (beeinflusst u.a. die Nahrungsaufnahme; höhere Glycinkonzentrationen in der Nahrung verbessern das Sättigungsempfinden)23 und in der Konjugation der Gallensäure und damit in der Absorption und Verdauung von Lipiden.1
In der durchschnittlichen westlichen Mischkost beträgt die Glycinzufuhr aufgrund des geringen Verzehrs von Knochenbrühe, Gelatine und anderen glycinreichen Lebensmitteln zumeist nur etwa ein Drittel der für eine optimierte Kollagensynthese benötigten Zufuhrmenge und vegetarische und vegane Ernährungsweisen liefern durchschnittlich noch etwas weniger.9 Traditionelle Ernährungsweisen, in denen Tiere „Nose to Tail“ verzehrt werden, liefern deutlich höhere Glycinmengen, da Bindegewebe, Knochenmark und weitere glycinreiche Teile des Tiers verzehrt werden.24 In einer Publikation zur Optimierung der Kollageneigensynthese durch Erhöhung der Glycinzufuhr heißt es zur optimalen Glycinzufuhr: „Eine Erhöhung der Glycinzufuhr auf 10 g kann eine […] 200-prozentige Erhöhung der Kollagensynthese erzielen“.20 Dass die Kollagensynthese durch Glycin drastisch erhöht werden kann und dass diese Erhöhung durch eine Glycingabe deutlich ausgeprägter als bei anderen kollagenbildenden Aminosäuren ausfällt, zeigte auch eine In-Vitro-Studie, deren Ergebnisse in Abbildung 2 illustriert werden.
Abb. 2: Erhöhung der Kollagensynthese durch Glycin, Prolin, Lysin, Isoleucin und Asparaginsäure20
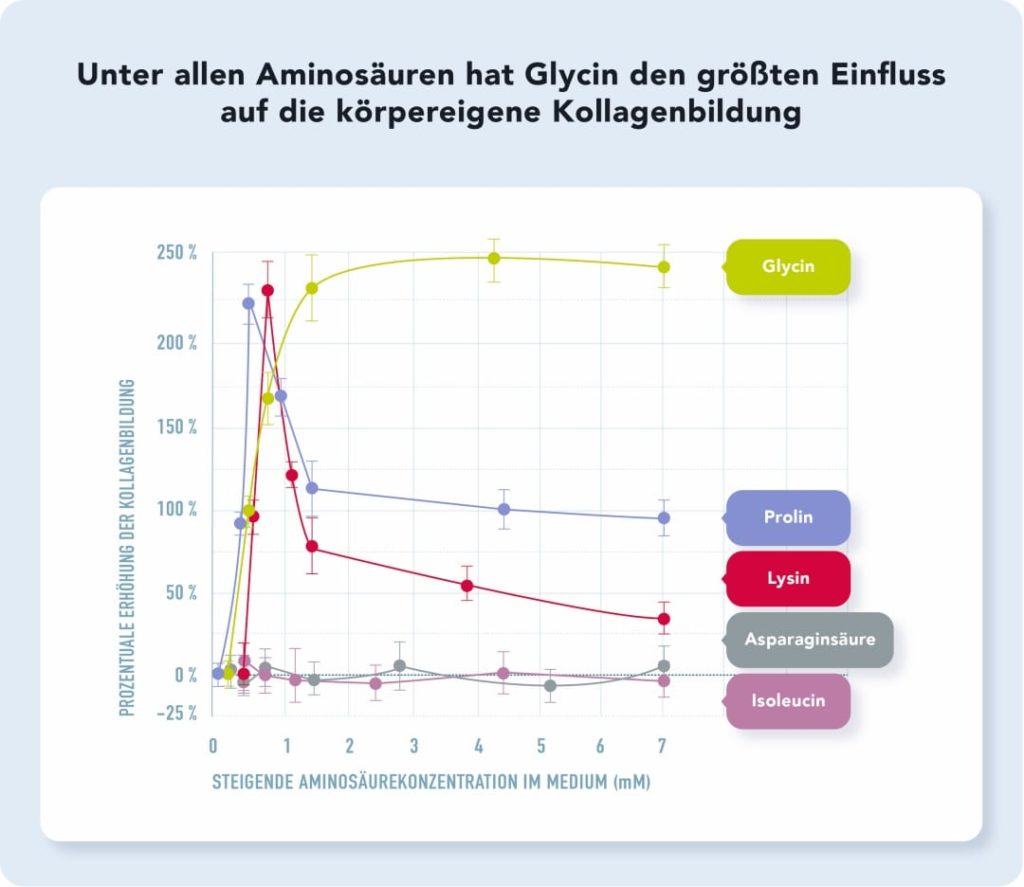
Da eine durchschnittliche westliche Kost zwischen 2,5 g (vegan) bis 3 g (omnivor) Glycin pro Tag liefert,9 benötigt es eine zusätzliche Zufuhr in Höhe von etwa 7 bis 8 g, um eine Optimalzufuhr im Sinne der Kollagensynthese zu erzielen. Reines Glycinpulver scheint dabei nicht nur ein gleichwertiger veganer Ersatz für Kollagenpulver zu sein, sondern dieses in Bezug auf die Effektivität sogar zu übertreffen. Dazu heißt es in einer Publikation: „Es können [im Vergleich zur selben Dosis an Kollagenhydrolysat] bessere Ergebnisse mit einer täglichen Glycinsupplementierung von 10 g Glycin erreicht werden, da 10 g Kollagenhydrolysat nur etwa 2,5 g Glycin enthalten, was unzureichend ist“.20 Zur Bedeutung von Glycin in der menschlichen Gesundheit schreiben die Autoren der Studie zur Kollagensynthese durch erhöhte Glycinzufuhr: „Glycin wird typischerweise als eine nicht-essenzielle Aminosäure klassifiziert, weil der Organismus diese aus Serin selbst bilden kann. […] Jedoch ist die Kapazität zur Glycin-Eigensynthese viel geringer als die benötigte Menge. […] Glycin ist [daher] eine essenzielle Aminosäure, die in ausreichender Menge in der Nahrung enthalten sein muss, um den Bedarf für die körpereigene Kollagensynthese zu decken“.

Die Autoren beziehen sich hier auf die typische westliche Mischkost und alle anderen Ernährungsweisen, die nicht in regelmäßigen Abständen Knochenbrühe, Gelatine und weitere Glycinquellen enthalten. Daher ist die Notwendigkeit der Glycinanreicherung der Nahrung bzw. der bis dahin überbrückenden Glycinsupplementierung mitnichten ein veganes Problem, das es zu lösen gilt. Es betrifft vielmehr den Großteil der westlichen Welt. Allerdings verschärft sich die Problemsituation in Bezug auf die Kollageneigensynthese bei veganer Kost noch weiter, da zum einen auch andere Substanzen abseits von Serin, die zur Glycinbildung herangezogen werden können (u.a. Cholin)25 in geringeren Mengen in der Nahrung vorliegen und zum anderen im Gegensatz zu pescetarischer bzw. vegetarischer und mischköstlicher Ernährung auch deutlich weniger an anderen wichtigen kollagenbildenden Aminosäuren wie Prolin konsumiert wird.9 Im Tiermodell zeigte sich, dass bei geringer Cholinzufuhr (vergleichbar mit vielen pflanzenbetonten Ernährungsweisen) bis zu 70 % des aufgenommenen Cholins zu Glycin konvertiert wurden, was zum einen die Cholinversorgung an anderen Stellen verschlechtert und zum anderen dazu führt, dass die Glycinsynthese bei niedriger Cholinzufuhr geringer ausfällt.1 Erwachsene können Glycin zu einem gewissen Grad (die Effektivität ist u.a. genetisch determiniert) mit Hilfe der Aminosäure Threonin bilden, jedoch verfügen Kleinkinder nicht über diese Fähigkeit, was eine ausreichende Glycinzufuhr bei ihnen besonders wichtig macht.
4. Quellen
- Razak, M.A., Begum, P.S., Viswanath, B. et al. (2017). Multifarious Beneficial Effect of Nonessential Amino Acid, Glycine: A Review. Oxidative Medicine and Cellular Longevity, 2017, 1–8.[↩][↩][↩][↩]
- de Miranda, R.B., Weimer, P. & Rossi, R.C. (2021). Effects of hydrolyzed collagen supplementation on skin aging: A systematic review and meta‐analysis. International Journal of Dermatology, 60(12), 1449–1461.[↩]
- Barati, M., Jabbari, M., Navekar, R. et al. (2020). Collagen supplementation for skin health: A mechanistic systematic review. Journal of Cosmetic Dermatology, 19(11), 2820–2829.[↩]
- Mathew-Steiner, S.S., Roy, S. & Sen, C. K. (2021). Collagen in Wound Healing. Bioengineering, 8(5), 63.[↩]
- Daneault, A., Coxam, V. et al. (2017). Biological Effect of Hydrolyzed Collagen on Bone Metabolism. Critical Reviews in Food Science and Nutrition, 1922–1937.[↩]
- Fusano, M., Fusano, I., Galimberti, M.G. et al. (2020). Comparison of Postsurgical Scars Between Vegan and Omnivore Patients. Dermatologic Surgery, 46(12), 1572–1576.[↩]
- Fusano, M., Galimberti, M.G., Bencini, M. et al. (2021). Comparison of microfocused ultrasound with visualization for skin laxity among vegan and omnivore patients. Journal of Cosmetic Dermatology, 20(9), 2769–2774.[↩]
- Karlic, H., Schuster, D., Varga, F. et al. (2008). Vegetarian Diet Affects Genes of Oxidative Metabolism and Collagen Synthesis. Annals of Nutrition and Metabolism, 53(1), 29–32.[↩][↩]
- Schmidt, J.A., Rinaldi, S., Scalbert, A. et al. (2016). Plasma concentrations and intakes of amino acids in male meat-eaters, fish-eaters, vegetarians and vegans: A cross-sectional analysis in the EPIC-Oxford cohort. European Journal of Clinical Nutrition, 70(3), 306–312.[↩][↩][↩][↩]
- Shuster, S. (2020). Osteoporosis, like skin ageing, is caused by collagen loss which is reversible. Journal of the Royal Society of Medicine, 113(4), 158–160.[↩]
- Tong, T.Y.N., Appleby, P.N., Armstrong, M.E.G. et al. (2020). Vegetarian and vegan diets and risks of total and site-specific fractures: Results from the prospective EPIC-Oxford study. BMC Medicine, 18(1), 353.[↩]
- Menzel, J., Abraham, K., Stangl, G.I. et al. (2021). Vegan Diet and Bone Health—Results from the Cross-Sectional RBVD Study. Nutrients, 13(2), 685.[↩]
- Ogilvie, A.R., McGuire, B.D., Meng, L. et al. (2022). Fracture Risk in Vegetarians and Vegans: The Role of Diet and Metabolic Factors. Current Osteoporosis Reports, 20(6), 442–452.[↩]
- Iguacel, I., Miguel-Berges, M.L., Gómez-Bruton, A. et al. (2019). Veganism, vegetarianism, bone mineral density, and fracture risk: A systematic review and meta-analysis. Nutrition Reviews, 77(1), 1–18.[↩]
- Ricard-Blum, S. (2011). The Collagen Family. Cold Spring Harbor Perspectives in Biology, 3(1), a004978–a004978.[↩]
- Barbul, A. (2008). Proline Precursors to Sustain Mammalian Collagen Synthesis. The Journal of Nutrition, 138(10), 2021S-2024S.[↩]
- Carvalho, A., Marques, A., Silva, T. et al. (2018). Evaluation of the Potential of Collagen from Codfish Skin as a Biomaterial for Biomedical Applications. Marine Drugs, 16(12), 495.[↩]
- Huang, W. (1977). Chemical and histochemical studies of human alveolar collagen fibers. Am J Pathol, 86, 81–97.[↩]
- Horng, J.-C., Kotch, F.W. & Raines, R.T. (2006). Is glycine a surrogate for a D-amino acid in the collagen triple helix? Protein Science, 16(2), 208–215.[↩]
- de Paz-Lugo, P., Lupiáñez, J.A. & Meléndez-Hevia, E. (2018). High glycine concentration increases collagen synthesis by articular chondrocytes in vitro: Acute glycine deficiency could be an important cause of osteoarthritis. Amino Acids, 50(10), 1357–1365.[↩][↩][↩][↩]
- McCarty, M., O’Keefe, J. & DiNicolantonio, J. (2018). Dietary Glycine Is Rate-Limiting for Glutathione Synthesis and May Have Broad Potential for Health Protection. Ochsner Journal, 18(1), 81–87.[↩]
- Gießing, J. (2019). Kreatin: Eine natürliche Substanz und ihre Bedeutung für Muskelaufbau, Fitness und Anti-Aging. BoD.[↩]
- Lim, J.J., Sequeira, I.R., Yip, W.C.Y. et al. (2022). Postprandial glycine as a biomarker of satiety: A dose-rising randomised control trial of whey protein in overweight women. Appetite, 169, 105871.[↩]
- Masterjohn, C. (2012). Beyond Good and Evil. Weston A. Price Foundation.[↩]
- Wang, W., Wu, Z., Dai, Z. et al. (2013). Glycine metabolism in animals and humans: Implications for nutrition and health. Amino Acids, 45(3), 463–477.[↩]
Immer auf dem Laufenden
Abonniere unseren Newsletter, um per Mail über neue Produkte, Produktupdates und wichtige News informiert zu werden.
Durch die Angabe deiner Email-Adresse stimmst du zu, dass wir dir unseren Newsletter zuschicken. Diese Einwilligung kannst du jederzeit mit Wirkung für die Zukunft widerrufen. Weitere Informationen findest du in unserer Datenschutzerklärung.

